****Sijoitusbloggari ja yksityissijoittaja Jarkko Ahon (Random Walker) yhtiöanalyysi Aplagon Oy:stä on nähtävissä sijoitusmateriaalin liitteistä sivuston alaosasta. Sivustolla tulee olla kirjautuneena sisään nähdäkseen koko materiaalin liitteineen. ****
Tiedot sijoituksesta
- Tyyppi:
- Osakeanti
- Sijoitettu:
- 2 227 944,00 €
- Jaettava omistusosuus:
- 8,22 – 16,47 %
- Osakkeen hinta :
-
24,00 €
minimisijoitus 35 osaketta
- Osakkeiden nykyinen lukumäärä:
- 465 020
- Osakekanta täyden diluution jälkeen:
- 512 277
- Valuaatio (pre-money):
- 11 160 480,00 €
Tarinamme
APAC on ensimmäinen vaurioituneiden verisuonten pintaan hakeutuva, verisuonitukosten paikalliseen ehkäisemiseen ja hoitoon tarkoitettu lääke
Aplagon on suomalainen lääkekehitysyritys, jonka kehittämä APAC on ensimmäinen vaurioituneiden verisuonten pintaan hakeutuva, verisuonitukosten paikalliseen ehkäisemiseen ja hoitoon tarkoitettu lääkeaihio.
Aplagon hakee nyt enintään 2,0 miljoonan euron rahoitusta voidakseen osoittaa vuosina 2021–2022 APACin alustavan turvallisuuden ja tehokkuuden potilastutkimuksissa (kliininen proof-of-concept) samanaikaisesti kahdessa eri käyttöaiheessa: COVID-19-sairaudessa ja keinomunuaishoitoon käytetyn veritien tukoksessa. Kliininen proof-of-concept on lääkekehityksessä ensimmäinen merkittävä arvonnousutapahtuma. Aplagonin aktiiviset pääsijoittajat ja yhtiön johto osallistuvat rahoituskierrokseen yhteensä 710 000 euron sijoituksella.
Pyrkimyksenä on löytää suunniteltujen kliinisten tutkimusten jälkeen globaali yhteistyökumppani APACin kaupallistamiseksi ja näin tarjota sijoittajille exit-mahdollisuus joko yhdellä kertaa tai vaiheittain.
Historia
Aplagon sai alkunsa professori Riitta Lassilan ja hänen tutkimusryhmänsä Wihurin tutkimuslaitoksessa tekemästä tutkimustyöstä, joka keskittyi mastosyyteistä (syöttösoluista) saataviin hepariiniproteoglykaaneihin (HEP-PG). Hepariiniproteoglykaaneja esiintyy mm. verisuonikudoksessa, jossa ne toimivat elimistön omina paikallisina verisuonten korjausmolekyyleinä ja estävät verihyytymien muodostumista verisuonten vauriokohdissa (antitromboottinen vaikutus). Professori Lassila tutkimusryhmineen havaitsi, että hepariiniproteoglykaanit toimivat tehokkaina verihiutale-estäjinä pienissä verisuonissa ja ahtautuneissa valtimoissa. Kun HEP-PG rakennetta jäljitellen liitetään tarkassa suhteessa toisiinsa kaksi nykyisin aktiivisessa kliinisessä käytössä olevaa lääkettä (fraktioimaton) hepariini (antikoagulantti) ja albumiini (maksan tuottama tärkeä valkuaisaine), saadaan aikaan paitsi verihiutale-esto (AP, Anti-Platelet) myös antikoagulaatiovaikutus (AC, AntiCoagulant). Tämä molekyylirakenne pystyy jarruttamaan kumpaakin verihyytymien muodostumismekanismia samanaikaisesti. Havainnon tuloksena syntyi lopulta APAC, luontaisia hepariiniproteoglykaaneja jäljittelevä lääkeaihio, jota Aplagon nyt kehittää ja kaupallistaa.
APACilla on veren hyytymiseston ohella toinenkin ainutlaatuinen ominaisuus: se hakeutuu vaurioituneiden verisuonten pintaan. APAC siis etsiytyy sinne, missä sitä tarvitaan: verihyytymien muodostumispaikkoihin valtimoiden vauriokohdissa. Verenvirtaus valtimoissa on voimakasta eivätkä nykyisin käytettävät lääkkeet kykene kiinnittymään vaurioituneen verisuonen seinämään. APAC tunnistaa vaurioituneet kohdat, kiinnittyy niihin ja pysyy vauriokohdassa tarvittavan pitkään, jotta vaurio ehtii parantua. APACin on lisäksi osoitettu estävän akuutteja munuaisvaurioita valtimotukosten jälkeen.
Vaurioituneiden verisuonten pintaan hakeutumisen ja paikallisen kaksoisvaikutuksen (verihiutale-esto ja antikoagulantti) ainutlaatuinen yhdistelmä mahdollistaa täysin uudenlaisen paikallisen hoitovaihtoehdon. Vaikutusmekanismiensa perusteella APACilla on useita mahdollisia käyttöaiheita, mutta keskitymme ensin niihin, joihin ei ole olemassa hyväksyttyä tai riittävän tehokasta hoitoa merkittävästä lääketieteellisestä tarpeesta huolimatta.
Hepariiniproteoglykaanilöydösten ja 20 vuoden kovan työn jälkeen APAC on nyt valmis kliinisiin tutkimuksiin COVID-19-taudin ja keinomunuaishoitoon käytetyn veritien tukoksen hoidossa. Tuloksia odotetaan seuraavien 12–18 kuukauden kuluessa. COVID-19 toimii myös ensimmäisenä askeleena laajemmalle useiden miljardien eurojen arvoiselle markkinalle vaikean tulehduksen ja verenmyrkytyksen aiheuttaman hyytymishäiriön (koagulopatian) torjunnassa. Toinen keskeinen ja markkinapotentiaaliltaan erittäin suuri käyttöaihe on kriittinen alaraajan hapenpuute, perifeerisen valtimosairauden myöhäisin vaihe, johon Aplagon niin ikään suunnittelee kliinistä tutkimusohjelmaa. Mihinkään näistä käyttöaiheista ei ole tällä hetkellä olemassa tai kehitteillä muita vastaavia hoitomuotoja. APACin toimintamekanismit tukevat myös valtimoiden aukipysyvyyttä verisuonikirurgisten ja muiden verisuonitoimenpiteiden, kuten munuaispotilaiden veritieyhteyden rakentamisen (valtimo-laskimo-liitos, AVF), yhteydessä.
Aplagonilla on yhteistyösopimus Intian johtaviin lääkeyhtiöihin kuuluvan Cadila Pharmaceuticals Ltd:n kanssa. Yhteistyö kattaa alustavat kliiniset tutkimukset COVID-19-taudissa ja keinomunuaishoitoon käytetyn veritien tukoksessa, mikä tarjoaa erittäin kustannustehokkaan tavan saada alustavia tehokkuus- ja turvallisuustuloksia potilailla. Aplagon pidättää itsellään kaikki oikeudet Intian ulkopuolella.
Aplagon on tähän mennessä kerännyt rahoitusta 9,3 miljoonaa euroa, joista 6,5 miljoonaa euroa on saatu pääomasijoituksina ja 2,8 miljoonaa euroa Business Finlandin (entinen Tekes) tutkimus- ja tuotekehitystukina.
Miksi sijoittaa Aplagoniin?
- APAC on ainutlaatuinen lääke, jonka kohdesairauksia voidaan hoitaa täysin uudella tavalla.
- APAC on kohdennettu useiden miljardien eurojen arvoisille markkinoille käyttöaiheissa, joissa lääketieteelliselle hoidolle on huomattava tarve.
- Aplagonin tavoitteena on osoittaa APACin alustava turvallisuus ja tehokkuus (kliininen proof-of-concept eli lääkekehityksen ensimmäinen merkittävä arvonnousukohta) kahdessa eri käyttöaiheessa samanaikaisesti seuraavien 12–18 kuukauden kuluessa.
- Aplagonin tavoite on alustavien kliinisten proof-of-concept -tutkimusten jälkeen solmia globaali yhteistyösopimus, joka tarjoaa sijoittajille exit-mahdollisuuden joko yhdellä kertaa tai vaiheittain.
- Aplagonilla on yhteistyösopimus Intian johtaviin lääkeyhtiöihin kuuluvan Cadila Pharmaceuticalsin kanssa. Tällä yhteistyöllä Aplagon saa käyttöönsä suuren yhtiön resurssit ja erittäin kustannustehokkaan väylän APACin kliinisten proof-of-concept -tutkimusten suorittamiseen.
- Aplagonilla on erittäin kokenut kansainvälinen tiimi ja kustannustehokas liiketoimintamalli.
- Aplagon tarjoaa mahdollisuuden houkutteleviin sijoitustuottoihin. Lääkevalmisteiden sopimusten arvot voivat kliinisten proof-of-concept-tutkimusten jälkeen olla jopa satoja miljoonia euroja (katso kohta "Arvonmääritys").
- Aplagonin aktiiviset pääsijoittajat, Jenny ja Antti Wihurin rahasto, Gösta Serlachiuksen taidesäätiö ja Innovestor Kasvurahasto I Ky, ja yhtiön toimiva johto Sakari Lassila, Riitta Lassila, Aki Prihti ja Harry Holthöfer, osallistuvat rahoituskierrokseen yhteensä 710 000 euron sijoituksella.
Mitä verisuonitukokset ovat ja mikä niiden merkitys on?
Veri on jatkuvassa virtauksessa oleva, elämälle välttämättömiä verisoluja sisältävä neste, joka koostuu plasmasta (valkuaisainepitoinen kudosneste), punasoluista, valkosoluista ja verihiutaleista. Sydän pumppaa verta keuhkoista hapetuksen jälkeen verenkiertoon kaikkialle elimistöön. Veri kuljettaa mukanaan happea (punasolut), huolehtii puolustusjärjestelmästä (valkosolut) ja pysäyttää tarvittaessa oikea-aikaisesti paikallisia verenvuotoja (hemostaasi) ja käynnistää haavojen paranemisen (verihiutaleet eli trombosyytit) ja kuljettaa pois kuona-aineita (maksan, munuaisten ja keuhkojen välityksellä).
Ei-toivotussa verihyytymässä eli tromboosissa verisuoneen kasvaa suuri hyytymä (trombi), joka heikentää verenvirtausta tai estää sen. Jos trombi tukkii valtimon, kohde-elimen kudos ei saa lainkaan happea. Tällöin syntyy infarkti eli kudoskuolio kohde-elimessä. Laskimotukoksesta verenpaluu hapetettavaksi häiriintyy. Verenkierron mukana kulkeutuvasta verihyytymästä käytetään nimitystä embolus. Se voi tukkia verisuonia ja aiheuttaa elinvaurioita kaukana lähtöpisteestä.
Sydän- ja verisuonitautien sekä syöpien aiheuttamat tromboottiset komplikaatiot ovat merkittävä kuolinsyy. Maailmanlaajuisesti yksi ihminen neljästä kuolee tromboosin jälkiseurauksiin.
Kun verisuoni vaurioituu, elimistön korjausmekanismi, hemostaasi, käynnistyy. Elimistö estää verenhukan ja elinvauriot vuoraamalla vauriokohdan verihiutaleiden ja fibriinin avulla. Prosessiin osallistuu verisoluja sekä useita valkuaisaineita ja entsyymejä, kuten hyytymistekijöitä. Alla olevassa kuvassa esitetään, miten normaalisti verisuonen vaurioituminen etenee verihyytymän muodostumiseen (verisuonivauriosta verenvuodon tyrehtymiseen). Jos hyytymisreaktio on tarpeettoman voimakas, syntyy verisuonen tukkiva hyytymä eli trombi.
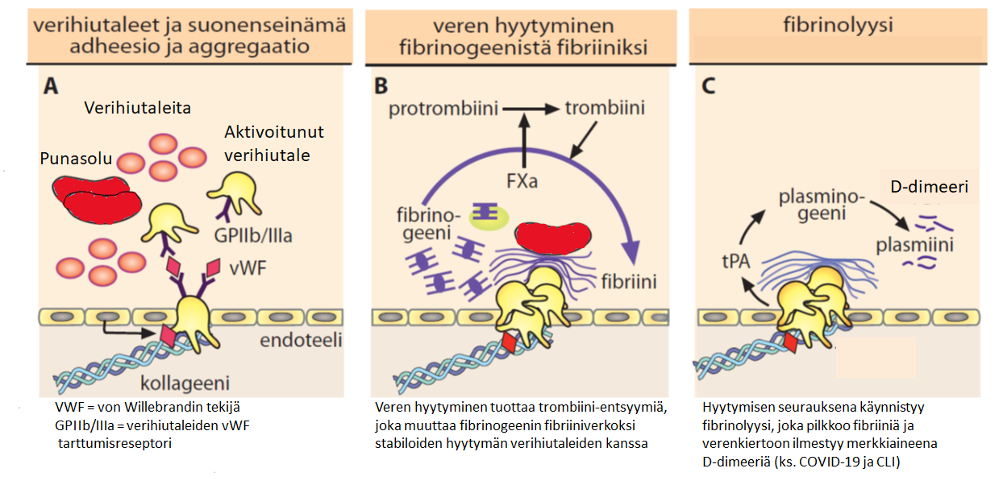
Lassila. Veritaudit, oppikirja, Blood diseases, textbook 2015. Toim. Porkka, Lassila, Remes, Savolainen, Duodecim, 2015.
Koska verihyytymä koostuu sekä verihiutaleista että fibriinistä, tehokkaimman mahdollisen antitromboottisen hoidon tulisi vaikuttaa näihin molempiin. Nykyisten antitromboottisten lääkkeiden vaikutus kohdistuu joko verihiutaleiden muodostumiseen (verihiutale-estäjä) tai hyytymistekijöihin (antikoagulantti). Veritulppien hoidossa näitä joudutaan yhdistämään ja seurauksena voi olla verenvuotoja, eli hemostaasi heikkenee. Mikään tällä hetkellä markkinoilla olevista antitromboottisista lääkkeistä ei ole samanaikaisesti sekä verihiutale-estäjä että antikoagulantti, eikä kohdennu paikallisesti verisuonen vauriokohtaan, johon hyytymä muodostuu. Nykyiset antitromboottiset lääkkeet ovat systeemisiä eli vaikuttavat koko elimistöön ja verenkiertoon, vaikka ongelmat ovat paikallisia. Systeemisten antitromboottisten lääkkeiden vakava haittavaikutus on verenvuoto, sillä pienen paikallisen tukoksen esto voi aiheuttaa verenvuodon riskiä muualla elimistössä.
Mikä APAC on?
Aplagonin APAC on lääkemolekyyli, joka koostuu kahdesta yleisesti käytössä olevasta biologisesta lääkkeestä, eläinperäisestä fraktioimattomasta hepariinista (UFH) ja ihmisen seerumin albumiinista (HSA). Sidosmolekyyli yhdistää eli konjugoi seerumin albumiiniin tietyn määrän UFH-ketjuja.
APAC jäljittelee syöttösoluperäisiä hepariiniproteoglykaaneja (HEP-PG) ja siksi myös elimistön omia puolustus- ja korjausmekanismeja.
Hepariiniproteoglykaaneja esiintyy verisuonikudoksessa, jossa ne toimivat paikallisina verisuonten korjausmolekyyleina ja estävät verihyytymien muodostumista verisuonten vauriokohdissa (antitromboottinen vaikutus).
Aplagon on tutkinut useita erilaisia APAC-konjugaatteja. Kliiniseen kehitykseen on valittu optimoitu APAC-konjugaatti.
Mikä tekee APACista ainutlaatuisen?
- Miten APAC eroaa kliinisessä käytössä olevista hepariineista?
- Kliinisessä käytössä olevia hepariineja (fraktioimaton hepariini [UFH] ja pienimolekyylinen hepariini [LMWH]) käytetään yleisesti systeemiseen antikoagulaatioon eli verihyytymien ehkäisyyn ja hoitoon koko elimistössä. UFH on laaja-alaisempi antikoagulantti, jota käytetään tavallisesti sairaaloissa laskimoon annettuna sydän-, verisuoni- ja plastiikkakirurgian yhteydessä. LMWH:ta sen sijaan käytetään useimmiten ihon alle annettavana pistoksena (subkutaanisesti) sekä sairaaloissa että avohoidossa. UFH on yksi APACin komponenteista, ja siten APACin lähin vertailukohta.
Alla olevassa kuvassa ja taulukossa APACin rakennetta ja toimintaa verrataan kliinisessä käytössä oleviin hepariineihin.

APACilla on samankaltainen antikoagulanttivaikutus kuin kliinisessä käytössä olevilla hepariineilla, minkä lisäksi APAC:lla on useita ainutlaatuisia ominaisuuksia, joista kerrotaan tarkemmin alla. Nämä ominaisuudet mahdollistavat APACin käytön käyttöaiheissa, joihin ei ole olemassa hyväksyttyä tai riittävän tehokasta hoitoa, mutta joissa lääketieteellinen tarve on suuri. Kattavampi yleisesitys ja tieteelliset julkaisut toimitetaan erikseen.
APAC on tehokas antikoagulantti
- APACilla on samankaltainen antikoagulanttivaikutus (AC) kuin kliinisessä käytössä olevilla hepariineilla. Prekliinisten tutkimusten perusteella APAC on jopa kliinisesti käytettäviä hepariineja tehokkaampi antikoagulantti, mikä mahdollistaa pienempien annosten käytön.
- APACin antikoagulanttivaikutus on tärkeä, sillä se voi suojata hyytymisaktivaation käynnistämältä verihyytymien muodostumiselta, jonka taustalla vaikuttavat sekä verihiutaleet että hyytymistekijät.
APAC on tehokas verihiutale-estäjä
- APAC on tehokas verihiutale-estäjä (AP), joka ehkäisee tehokkaasti kollageenin ja trombiinin laukaisemaa verihiutaleiden aktivoitumista ja kasaantumista. APAC ei kuitenkaan estä verihiutaleiden muita tehtäviä hemostaasin käynnistymisessä (eli verihiutaleiden kiinnittymistä vauriokohtaan ja sitä seuraavaa aktivoitumista), mikä on elimistön luontainen tapa estää verenvuoto vauriokohdassa ja korjata vaurioita.
- APACin verihiutaleiden esto-ominaisuus on tärkeä, sillä APAC voi estää verihiutaleiden aikaansaaman korjausreaktion (hemostaasin) etenemisen hyytymisvaiheeseen, erityisesti ahtautuvien valtimoverisuonten ja mikroverenkierron vauriokohdissa.
- APACissa ainutlaatuista ja erityisen hyödyllistä on, että se toimii samanaikaisesti sekä antikoagulanttina että verihiutale-estäjänä.
APAC kohdentuu verisuonen vauriokohtaan
- APAC etsiytyy verisuonen vauriokohtaan ja kiinnittyy siihen pitkäaikaisesti. Jos suonenseinämä on ehjä (vaurioitumaton), APAC ei kiinnity siihen.
- Vaurioituneiden verisuonten pintaan hakeutuminen on erityisen tärkeää valtimoissa, joissa verenvirtaus on voimakasta. Vaurioituneissa valtimoissa APAC kiinnittyy vain niihin kohtiin, jotka altistuvat verihyytymien muodostukselle (endoteelikerroksen alaisen kollageenin paljastuminen). Vaurioituneiden verisuonten pintaan hakeutuminen on APACin ainutlaatuinen ominaisuus.
APAC etsiytyy verisuonten vauriokohtiin ja estää tukokset sekä systeemisesti (laskimoon) että paikallisesti annosteltuna
- APACilla on kyky hakeutua ja säilyä vaurioituneiden verisuonten pinnassa sekä paikallisesti että systeemisesti annosteltuna. Tämän ainutlaatuisen ominaisuuden takia APAC soveltuu useaan potentiaaliseen kohdekäyttöaiheeseen ja kuhunkin kohdekäyttöaiheeseen parhaiten soveltuva antotapa voidaan valita joustavasti. Esimerkiksi keinomunuaishoitoon käytetyn veritien tukosta estetään yksittäisellä paikallisella APAC-annoksella, kun taas COVID-19-taudissa käytetään laskimoinfuusioita.
APACilla verenvuotoriski on alhaisempi kuin UFH:lla
- Verenvuotoaikaan perustuvalla mallilla testattuna APAC pidensi vuotoaikaa vähemmän kuin UFH samoilla hepariinipitoisuuksilla. Lyhyempi verenvuotoaika tarkoittaa pienempää vuotoriskiä, joka on mahdollinen kaikkien antitromboottisten lääkkeiden vakava haittavaikutus (myös hepariineilla). Vuotoriski kasvaa merkittävästi, jos potilaan akuutin valtimotromboosin hoidossa on käytettävä erillisiä systeemisesti vaikuttavia antikoagulantteja ja verihiutale-estäjiä samanaikaisesti. APACilla on molemmat antitromboottiset vaikutukset, mutta pääasiassa paikallisesti ja annostarve on pienempi.
- Vuotoriskiä vähentää APACin hakeutuminen vauriokohtaan. Koska APAC hakeutuu verisuonten vauriokohtiin ja kiinnittyy sinne pitkäaikaisesti, jatkuva systeeminen antikoagulantti- ja/tai verihiutale-estäjähoito saattaa olla tarpeeton.
APAC ehkäisee akuuttia munuaisvauriota
- APAC esti äkillisen munuaisvaurion syntymisen rottien munuaisvaltimon tukosmallissa, kun taas UFH:llä ei ollut tätä suojaavaa vaikutusta.
- Äkillinen munuaisvaurio on verenkierron estymisen (iskemia) jälkeinen kudosvaurio, kun verenkierto verisuonitoimenpiteellä palautetaan hapenpuutteesta kärsivään kudokseen (iskemia-reperfuusiovaurio). Sen ehkäiseminen on tärkeää, koska iskemian aiheuttama hapenpuute on keskeinen ongelma monissa APACin potentiaalisissa kohdekäyttöaiheissa (COVID-19, perifeerinen valtimosairaus / kriittinen alaraajan hapenpuute ja keinomunuaishoitoon käytetyn veritien tukos).
- Lisäksi äkillinen munuaisvaurio (acute kidney injury, AKI) on suhteellisen yleinen ja usein kuolemaan johtava komplikaatio COVID-19-taudin vakavaa muotoa sairastavilla potilailla. Monien verisuonisairauksien yhteydessä esiintyy munuaisvaurioita (krooninen munuaissairaus [chronic kidney disease, CKD]) Diabeetikoilla on usein sekä krooninen munuaissairaus että kriittinen alaraajan hapenpuute (critical limb ischemia, CLI).
APACilla on useita muita ainutlaatuisia ominaisuuksia
- APAC suojelee verisuonten sileitä lihassoluja
- APAC estää tehokkaasti verisuonten sileiden lihassolujen (VSMC) liikakasvua. APACilla on edullisia vaikutuksia verisuonten sileisiin lihassoluihin in vitro -tutkimuksissa (laboratoriossa), sillä se pitää yllä sileiden lihassolujen supistumiskykyä niiden liikakasvun sijaan. Kudostasolla APAC rauhoittaa verisuonitukoksista ja muista tautiprosesseista aiheutuvia tulehdustiloja.
- Vaikutus sileisiin lihassoluihin on tärkeä, koska vaurion (esimerkiksi leikkaus, jossa yhdistetään yläraajan valtimo ja laskimo ja luodaan ns. fisteli keinomunuaishoidon veritieksi) jälkeen suonenseinämän sileiden lihassolujen haitallinen kasvu kaventaa verisuonen sisäläpimittaa ja lisää tukosriskiä. Verisuonten sileät lihassolut osallistuvat merkittävästi ateroskleroosin (kolesteroliplakkien kertyminen ja valtimoseinämien tulehdus) kehittymiseen.
- APAC vähentää kudostekijän synteesiä
- Kudostekijä on proteiini, jota esiintyy suonenseinämän syvemmissä kerroksissa (verisuonten sisäpintaa peittävien endoteelisolujen alla) ja leukosyyteissä (valkosoluissa). Kudostekijällä on erityinen merkitys veren hyytymisen käynnistämisessä. APACin on osoitettu suonivaurioalueilla ja verenkierrossa vähentävän kudostekijän määrää.
- Kudostekijän liikatuotantoa on havaittu monissa kliinisissä tiloissa, kuten infektioissa (esim. COVID-19-taudissa), sydän- ja verisuonitaudeissa (esim. perifeerisessä valtimosairaudessa ja alaraajan kriittisessä hapenpuutteessa), syövässä ja diabeteksessa. Kudostekijä pitää lisäksi yllä tulehdusta.
APAC ehkäisee komplementtijärjestelmän haitallista toimintaa
- APACin on osoitettu estävän komplementtijärjestelmän tarpeetonta aktivaatiota. Komplementtijärjestelmä on osa immuunijärjestelmää. Komplementtijärjestelmän yliaktivaation estäminen tulehduksen aikana, kuten vakavassa COVID-19-taudissa / sepsiksessä, on tärkeää, sillä komplementtijärjestelmä voi edistää myös veren liiallista hyytymistä.
Liiketoiminta- & markkinatilanteemme
Lääketeollisuus
Aplagon on lääkekehitysyritys.
Lääketeollisuus kehittää, valmistaa ja markkinoi lääkehoidoissa käytettäviä lääkevalmisteita. Lääketeollisuuden globaalien markkinoiden koko vuonna 2019 oli 1,25 biljoonaa dollaria [Statista]. Lääketeollisuus on maailmanlaajuisesti tutkimuksen ja tuotekehityksen suurin investoija [Schuhmacher et al. J Transl Med 2016]. Monikansallisissa lääkeyhtiöissä 50 prosenttia tutkimus- ja tuotekehitysvaiheen tuotteista oli peräisin ulkoisista lähteistä (pienemmistä tutkimukseen ja tuotekehitykseen keskittyvistä yrityksistä, kuten Aplagon, tai yliopistoista) jo vuonna 2013 [Schuhmacher et al. Drug Discov Today 2013]. Luku on tällä hetkellä todennäköisesti suurempi.
Lääkekehitysprosessi
Ennen kuin lääkkeelle voidaan myöntää myyntilupa, se käy läpi perinpohjaisen kehitysprosessin, johon sisältyvät kansainvälisten säädösten mukaisesti tehdyt prekliiniset ja kliiniset tutkimukset. Testauksen aikana saadaan todisteita lääkkeen turvallisuudesta ja tehokkuudesta kohdekäyttöaiheensa hoidossa. Usein esitetty arvio on, että uuden lääkkeen kehitystyö vie 10–15 vuotta.
Kehitysprosessi jakautuu useimmiten seuraaviin vaiheisiin:
- Prekliiniset tutkimukset: Ennen kliinisiä tutkimuksia kokeellista lääkettä tutkitaan kattavasti prekliinisessä vaiheessa. Lääkemolekyylille tehdään tutkimuksia sekä in vitro (koeputkessa tai soluviljelmässä) että in vivo (eläinmalli), joilla saadaan alustavaa tietoa tehokkuudesta, turvallisuudesta ja farmakokinetiikasta (imeytyminen, jakaantuminen elimistössä, aineenvaihdunta ja erittyminen).
- Faasin 1 aikana kokeellisen lääkkeen turvallisuutta, annostelua ja keskeisiä ominaisuuksia tutkitaan yleensä terveillä vapaaehtoisilla henkilöillä. Joissakin tapauksissa faasin 1 tutkimuksia voidaan tehdä myös potilailla, esimerkiksi leikkausta edellyttävissä tapauksissa (kuten keinomunuaishoitoon käytetyn veritien tukosta koskevassa APAC-tutkimuksessa).
- Faasin 2 tutkimuksissa arvioidaan lääkkeen tehokkuutta ja saadaan tarkempia tietoja turvallisuudesta.
- Faasin 3 tutkimuksissa lääkkeen tehokkuutta verrataan nykyiseen parhaaseen hoitomuotoon. Tämän vaiheen tutkimukset ovat tavallisesti laajalla potilasjoukolla tehtäviä satunnaistettuja kontrolloituja monikeskustutkimuksia. Myyntilupahakemus toimitetaan onnistuneiden faasin 3 tutkimusten jälkeen.
Aplagon on testannut ja osoittanut APACin toimivuuden ja tehokkuuden useilla prekliinisillä ihmisen veren ja plasman tutkimuksilla in vitro sekä useilla eläinmallitutkimuksilla in vivo. Lisäksi Aplagon on suorittanut kaikki sääntelyviranomaisten edellyttämät toksikologiset tutkimukset eri eläinlajeilla. Niissä tutkittiin annostusta ja määritettiin turvamarginaalit suunniteltuja kliinisiä tutkimuksia varten valituissa käyttöaiheissa. APAC on nyt valmis ihmisillä tehtäviin kliinisiin tutkimuksiin (faasien 1 ja 2 tutkimukset).
Aplagonin liiketoimintamalli
Aplagonin tavoitteena on osoittaa APACin alustava tehokkuus ja turvallisuus (kliininen proof-of-concept -tutkimus) seuraavan 12–18 kuukauden kuluessa vähintään kahdessa käyttöaiheessa, COVID-19-taudissa ja keinomunuaishoitoon käytetyn veritien tukoksessa. Sen jälkeen tavoitteena on löytää kaupallistamiskumppani APACin myöhäisvaiheen kehitykseen ja kaupallistamiseen Intian ulkopuolella.
Yhteistyösopimukseen odotetaan sisältyvän merkittäviä milestone- ja rojaltimaksuja. Kliinisen vaiheen tutkimuslääkkeissä pelkät milestone-maksut ovat usein yli 100 miljoonaa euroa.
APACin kaupallistamissopimus tarjoaisi sijoittajille lisäksi exit-mahdollisuuden. Se toteutuu todennäköisesti kaupallistamiskumppanin tekemän yritysoston, APACin oikeudet yhteystyökumppanille antavan lisenssisopimuksen tai pörssiyhtiöön sulautumisen kautta.
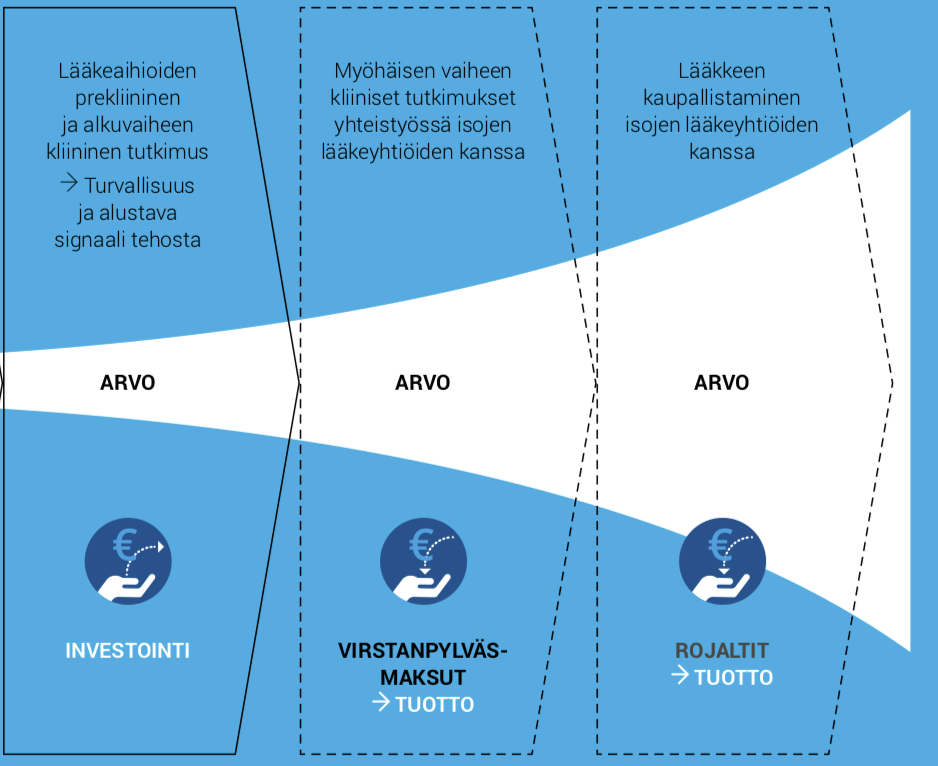
Lähde: muokattu versio Herantis Pharman vuoden 2019 vuosikertomuksessa käytetystä kaaviosta.
Esimerkki yhteystyösopimuksesta samankaltaisessa käyttöaiheessa:
- Alankomaalainen lääkeyhtiö AM-Pharma kehitti sepsikseen liittyvän akuutin munuaisvaurion (SA-AKI) hoitoon uudenlaisen tulehdusreaktioita estävän yhdisteen, rekombinantin ihmisen alkalisen fosfataasin. Toukokuussa 2015 AM-Pharma solmi sopimuksen Pfizerin kanssa. Sopimuksen ehtojen mukaisesti Pfizer osti vähemmistöosuuden 87,5 miljoonalla dollarilla ja sai yksinoikeuden (option) ostaa koko yritys. Sopimukseen kuuluivat lisäksi enintään 512,5 miljoonan dollarin option käyttöön ja tuotteiden markkinoille tuloon liittyvät lisämaksut. AM-Pharmalla olivat tuolloin menossa faasin 2 kliiniset tutkimukset sepsikseen liittyvän akuutin munuaisvaurion hoidossa. Jo aiemmin oli saatu päätökseen eläinperäisellä alkalisella fosfataasilla tehty faasin 2 tutkimus.
Yhteistyösopimus Cadila Pharmaceuticalsin kanssa
Aplagon ja Cadila Pharmaceuticals (tästä eteenpäin Cadila) solmivat toukokuussa 2017 yhteistyösopimuksen APACin kehittämisestä. Cadila on Intian suurimpia yksityisomistuksessa olevia lääkeyhtiöitä. Yhteistyö kattaa alkuvaiheen kliiniset proof-of-concept -tutkimukset keinomunuaishoitoon käytetyn veritien tukoksessa ja COVID-19-taudissa sekä APACin valmistuksen kliinisiä tutkimuksia varten. Aplagonilla on lisäksi optio faasin 2/3 kliiniseen tutkimukseen keinomunuaishoitoon käytetyn veritien tukoksessa enintään 360 potilaalla. Kliiniset tutkimukset tehdään Intiassa niin, että tutkimuksissa saadut tiedot ovat myös FDA:n (Yhdysvallat) ja EMA:n (Eurooppa) vaatimusten mukaisia. Cadilalla on markkinointioikeudet Intiassa ja Aplagonilla kaikilla muilla markkinoilla. Kun kliinistä dataa on saatu riittävästi, Aplagonin vastuulla on solmia APACin kaupallistamissopimus myöhäisemmän vaiheen kliinisestä kehityksestä, markkinoinnista ja myynnistä Intian ulkopuolella. Cadila maksaa Aplagonille pienimuotoista rojaltia Intian markkinoiden myynnistä. Aplagon taas maksaa Cadilalle (kohtuullista) voitto-osuutta Intian ulkopuolisista kaupallistamistuloista. Mikäli Aplagon myydään, voitto-osuus maksetaan kaupallistamistulojen sijaan exit-tuotoista.
Yhteistyö Cadilan kanssa tarjoaa Aplagonille erittäin kustannustehokkaan keinon saada alustavia tehokkuus- ja turvallisuustuloksia potilailla kahdessa käyttöaiheessa samanaikaisesti.
Ensimmäiset kohdekäyttöaiheet
Aplagonin ensimmäiset kliiniset käyttöaiheet ovat COVID-19 (systeeminen annostelu) ja keinomunuaishoitoon käytetyn veritien turvaaminen (paikallinen annostelu). Lisäksi Aplagon suunnittelee käynnistävänsä kliinisen tutkimusohjelman pitkälle edenneessä perifeerisessä valtimosairaudessa / alaraajan kriittisessä hapenpuutteessa.
Aplagonin odotuksena on, että APACia tullaan lopulta käyttämään monissa eri käyttöaiheissa. Taustatekijöillä – verisuonten vaurioitumisella, verihiutaleaktivaatiolla ja -kasaantumisella sekä hyytymisaktivaatiolla – on keskeinen rooli monissa sairauksissa ja häiriötiloissa.
COVID-19
Kuvaus
COVID-19 on suurelta osin verihyytymien riskiä lisäävä eli tromboottinen tauti. Vuonna 2019 alkunsa saanut koronavirustauti (COVID-19) on aiheuttanut ennennäkemättömän laajan terveydellisen kriisin. Maailman terveysjärjestö WHO julisti sen pandemiaksi 11. maaliskuuta 2020. COVID-19-taudissa ilmaantuvuus, vakavuus ja kuolleisuus ovat kolme kertaa tavallista influenssa A:ta suurempia. COVID-19-taudin takia sairaalahoitoon joutuneilla potilailla on suuri laskimo- ja valtimotukosten sekä mikroangiopatian (keuhkoissa ja muissa elimissä esiintyvän pienten verisuonien sairauden) riski. Niinpä tämän virustaudin hoitotulokset ovat heikkoja ja kuolleisuus suurta verisuonitukosten riskiryhmissä [Zhou et al. The Lancet 2020; Cattaneo et al. Thromb Haemost 2020].
Hyytymisen merkitys COVID-19-taudissa
Säätelemätön veren hyytyminen edistää COVID-19-taudin etenemistä ja lisää kuolleisuutta.
Systeemisen tason hyytymisaktivaatio näkyy muun muassa fibrinogeenin ja D-dimeerin kaltaisissa biomarkkereissa. Fibriiniä muodostuu hyytymisen yhteydessä fibrinogeenista. D-dimeeriä ilmaantuu verenkiertoon fibriinin hajotessa, kun koagulaatiossa muodostuneet verihyytymät pilkkoutuvat fibrinolyysin avulla.
D-dimeerin määrän voimakas nousu kuvastaa taudin etenemistä ja kuolleisuusriskiä, kuten alla olevassa kuvassa esitetään.
D-dimeeri COVID-19-potilailla
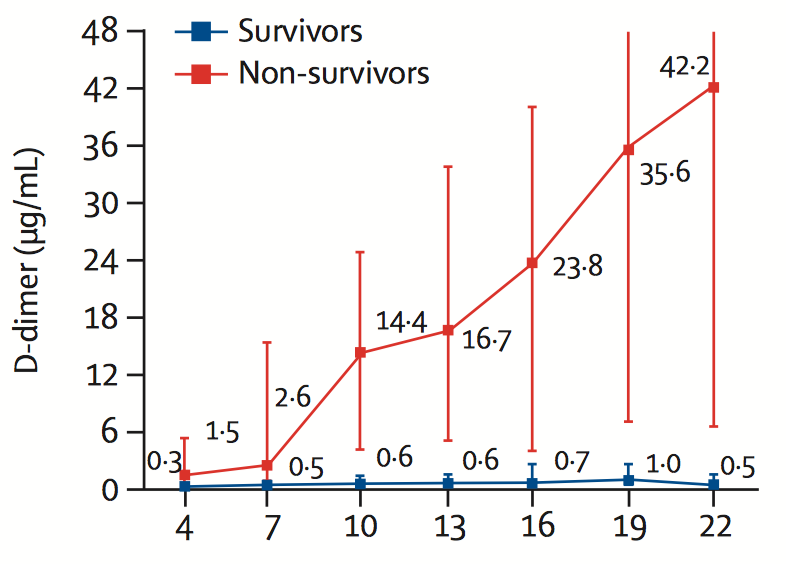
Zhou et al. The Lancet, 2020
COVID-19-taudin vakavissa muodoissa esiintyy keuhkotulehduksen ja pienten verisuonten tukkeutumisen takia usein hengitysvaikeuksia ja happivajetta, joihin tarvitaan mekaanista ventilaatiota. Tukoksia kehittyy virusinfektion ja vakavan tulehduksen vaurioittamissa verisuonissa. Ruumiinavaustutkimusten perusteella verihiutaleiden muodostamia trombeja on havaittu keuhkoissa, maksassa, munuaisissa ja sydämen mikroverenkierrossa [Ackermann et al. New Eng J Med. 2020]. Kolmasosalla taudin vakavaa muotoa sairastavista potilaista esiintyy lisäksi laskimotukoksia, joiden emboliat voivat ajautua hengenvaarallisesti suuriin keuhkovaltimoihin (keuhkoveritulppa).
Alhaalla olevassa kuvassa näytetään terveet keuhkot (kuvan vasemmalla puolella) ja COVID-19-taudin vaurioittamat keuhkot (oikealla). Hapen kulkeutuminen infektoituneista keuhkoista mikroverenkiertoon estyy fibriinin muodostumisen ja tromboosin takia. Tällöin potilaalle ilmaantuu äkillinen hengitysvaikeusoireyhtymä (ARDS), joka vaatii tehohoitoa.
COVID-19 aiheuttaa epänormaalia systeemistä koagulaatiota, jota paikallinen sääntely ei pysty hillitsemään
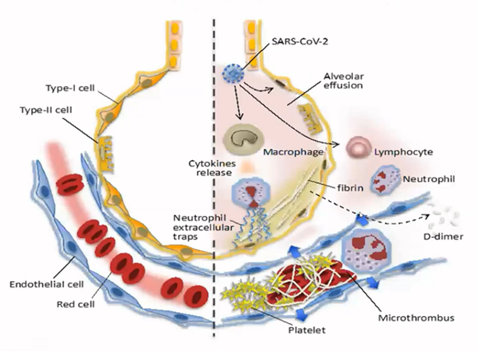
Iba T et al, 2020
Kuolleisuus voi olla jopa 70 prosenttia COVID-19-potilailla, joille kehittyy DIC-oireyhtymä / sepsiksen aiheuttama koagulopatia (SIC) eli systeeminen sääntelemätön hyytyminen, verrattuna 0,6 prosenttiin potilailla, joilla näitä hyytymishäiriöitä ei ole (Tang et al. JTH 2020). COVID-19-taudin vakava muoto johtaa usein monielinhäiriöön (keuhkot, munuaiset, sydän, suolisto) mikrotromboosien (pienten valtimoiden verihyytymien) takia. Äkillisen munuaisvaurion (AKI) ennuste on erittäin huono COVID-19-tautia sairastavilla potilailla. Meta-analyysissa kuolleisuuden on todettu olevan 76,5 % (95 %:n luottamusväli: 61,0–89,0) [Chen et al. Crit Care 2020].
APAC COVID-19-taudissa
APACin ainutlaatuiset ominaisuudet soveltuvat hyvin COVID-19-taudin komplikaatioiden hoitoon, kuten alla oleva kuva osoittaa.
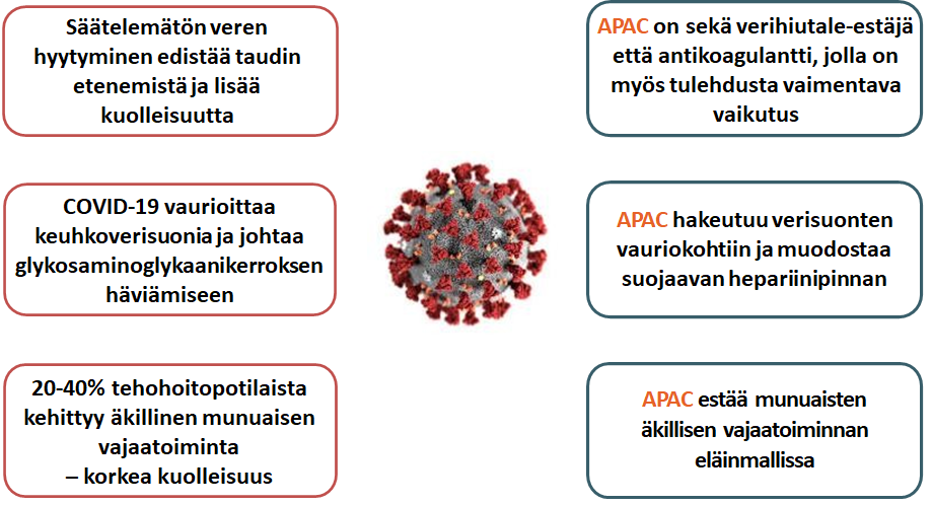
APAC on tarkoitettu hoitomuodoksi sairaalahoidossa oleville, suuren riskin COVID-19-potilaille. Suunnitteilla olevassa kliinisessä tutkimuksessa APACia annetaan jo lisähappea tarvitseville potilaille, jotka eivät kuitenkaan vielä tarvitse mekaanista ventilaatiota tai tehohoitoa, ja joilla on samanaikaisia merkkejä lisääntyneestä hyytymisaktivaatiosta (esim. veressä kohonnut D-dimeerin pitoisuus). Tavoitteena on estää taudin vaikeutuminen.
COVID-19 – mahdollisuus muiden tulehduksellisten hyytymishäiriöiden hoitoon – useiden miljardien eurojen lääkemarkkina
Sepsis on elimistön äärimmäinen, henkeä uhkaava tulehdusreaktio, joka voi nopeasti johtaa verisuonten vaurioihin, elinvaurioihin ja kuolemaan (Yhdysvaltain tautikeskus [Centers for Disease Control and Prevention]). Sepsiksen aiheuttama hyytymishäiriö, koagulopatia (SIC) johtaa systeemiseen säätelemättömään veren hyytymiseen ja ennakoi sepsispotilaiden suurempaa kuolleisuutta (yli 30 %). Mikrotromboosit ovat keskeisessä roolissa kaikissa sepsiksen aiheuttamissa monielinvaurioissa ja hyytymishäiriöissä, myös COVID-19-taudissa.
Sepsis on merkittävin kuolinsyy vakavasti sairailla potilailla ja kallein sairaaloissa hoidettava sairaus. Sepsiksen aiheuttama hyytymishäiriö on sen vuoksi useiden miljardien eurojen arvoinen lääkemarkkina.
Nykyiset hoitomuodot ja kilpailutilanne
COVID-19-taudin hoitovaihtoehdot ovat vajavaisia. Jonkinasteisia tuloksia saavutetaan eräillä viruslääkkeillä, kortikosteroideilla, hepariineilla ja elinten tukihoidoilla (kuten hemodialyysit). Sepsiksessä turvaudutaan samankaltaisiin hoitomahdollisuuksiin. Jos infektion aiheuttaja on bakteeri, hoidossa käytetään myös antibiootteja.
COVID-19-tautiin on kehitteillä monia hoitovaihtoehtoja. Niissä vaikutusmekanismi on kuitenkin erilainen kuin APACissa, ja useimmat niistä olisivat todennäköisemmin APACia täydentäviä kuin sitä korvaavia (esimerkiksi tulehdus- ja infektiolääkkeet).
Keinomunuaishoitoon käytetyn veritien tukos
Kuvaus
Munuaisilla on elimistön kannalta useita kriittisiä tehtäviä, sillä ne suodattavat verestä pois kuona-aineita ja ylimääräistä nestettä, tuottavat virtsaa ja pitävät yllä normaalia veden, suolojen ja mineraalien tasapainoa. Munuaiset voivat menettää suurimman osan tai koko toimintakykynsä useissa erilaisissa kliinisissä tiloissa. Loppuvaiheen munuaissairautta (munuaisten vajaatoimintaa) sairastavat potilaat tarvitsevat hemodialyysia, hengen pelastavaa hoitomuotoa, jota ei voi antaa ilman toimivaa veritietä. Hemodialyysissa potilas kytketään veritien välityksellä säännöllisesti dialyysikoneeseen, joka korvaa munuaisten toiminnan. Potilaan veri kiertää dialyysikoneen kautta, jossa siitä poistetaan ylimääräinen vesi, liukoiset aineet ja toksiinit. Dialyysihoitoa annetaan useimmiten kolme kertaa viikossa pari tuntia kerrallaan.
Paras vaihtoehto veritieksi on valtimo-laskimofisteli (AVF). Sen muodostaa verisuonikirurgi yhdistämällä toisiinsa valtimon ja laskimon potilaan ei-dominoivassa yläraajassa. Hemodialyysin veritietä muodostettaessa suositeltava vaihtoehto on ommella ranteen yläpuolella värttinävaltimo kiinni käsivarren ulompaan iholaskimoon. Näin potentiaaliset veritiepaikat säilyvät ylempänä käsivarressa myöhempien fisteleiden luomista varten. AVF:n kypsyminen käyttökelpoiseksi veritieksi kestää tavallisesti neljä viikkoa, jonka jälkeen dialyysihoito mahdollistuu. Alla olevasta kuvasta näkyy, kuinka AVF luodaan.
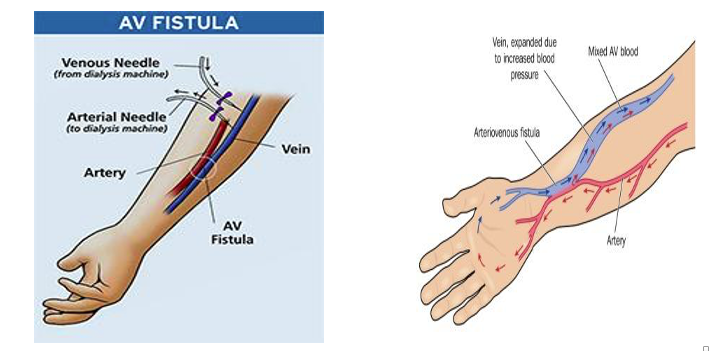
Veritien muodostaminen ja ylläpitäminen on haastavaa. Veritien tukos tai häiriö on merkittävin sairaalajaksojen ja sairastuvuuden syy pitkälle edennyttä kroonista munuaissairautta sairastavilla potilailla. Jonkin aikaa sitten suoritettiin faasin 3 kliininen tutkimus potilailla, joille oli hiljattain muodostettu värttinävaltimon ja käsivarren ulomman iholaskimon yhdistävä fisteli. Kontrolliryhmässä ensimmäisen vuoden aikana 47 prosenttia fisteleistä ei kypsynyt kunnolla ja 69 prosenttia ei pysynyt auki (epäonnistui).
Fistelitukoksia hoidetaan verisuonikirurgialla tai muilla rekonstruktiotoimenpiteillä, mutta merkittävä osa fisteleistä on hylättävä ja rakennettava uudestaan. Sairastuvuus-, kuolleisuus- ja hoitokustannusluvut ovat huomattavia. FDA on määrittänyt keinomunuaishoitoon käytetyn veritien tukoksen nopeutetun käsittelyn käyttöaiheeksi. Se on siis vakava tai henkeä uhkaava tila, johon ei ole olemassa tehokasta hoitoa.
Nykyiset hoitomuodot
Valtimo-laskimofistelin tukkeutumisen ehkäisemiseen ei tällä hetkellä ole olemassa tehokasta hoitoa. Valtimo-laskimofistelin avoimuus yritetään usein palauttaa angioplastialla (laajentamalla verisuonta pallokatetrilla) tai uusintaleikkauksella. Nämä toimenpiteet ovat kalliita, invasiivisia ja voivat aiheuttaa erilaisia komplikaatioita. Usein ne myös epäonnistuvat tai vaativat uusintatoimenpidettä. Esimerkiksi yhdysvaltalaisten suositusten mukaan valtimo-laskimofistelin pallolaajennuksessa hoitotavoitteena on fistelin auki pysyminen 6 kuukauden ajan [National Kidney Foundation (US): Clinical Practice Guidelines and Recommendations for Vascular Access 2006].
Markkinamahdollisuudet
Keinomunuaishoitoon käytetyn veritien tukoksen tehokkaalle estohoidolle on merkittävä lääketieteellinen tarve. Keinomunuaishoitoon käytetyn veritien häiriöiden hoitamisen arvioidaan maksavan Yhdysvalloissa 2,9 miljardia dollaria joka vuosi. Yhdysvalloissa arvioitiin olevan vuonna 2013/2014 noin 429 000 hemodialyysipotilasta, Euroopassa 315 000, Japanissa 315 000 ja maailmanlaajuisesti yli 2 miljoonaa. Määrä kasvaa vuosittain 6-7 prosenttia lähinnä diabeteksen lisääntymisen takia. Yhdysvalloissa tehdään joka vuosi noin 130 000 valtimo-laskimofisteliä. Fistelipotilaat tarvitsevat keskimäärin yli 1,5 toimenpidettä joka vuosi fistelin ylläpitämiseen. Jokainen toimenpide maksaa 5 000–15 000 dollaria. Valtimo-laskimofisteli tulee keskimäärin maksamaan yli 17 000 dollaria ensimmäisenä vuonna toimenpiteen jälkeen [Proteon Therapeutics 2017 10K-raportti]. Osakeanalyytikon arvioiden mukaan pelkästään valtimo-laskimofistelin kypsymismarkkinoiden globaali myyntipotentiaali on noin 500 miljoonaa dollaria vuodessa.
Kilpailevat tuotteet
Yhdysvalloissa on käynnissä satunnaistettu kliininen tutkimus keinomunuaishoitoon käytetyn veritien tukoksesta seuraavilla tuotteilla: Laminate Medicalin kehittämä, Nitinol-muistimetallista valmistettu, verisuonen ulkopuolelle asetettava tukiverkko (VasQ) sekä Vascular Therapiesin kehittämä, sirolimuusia erittävä kollageeni-istute. Molemmat tuotteet asetetaan valtimo-laskimofistelin ympärille (ulkopuolelle) sen muodostamisen yhteydessä. VasQ:lle on myönnetty CE-merkintä Euroopassa, ja sitä myydään sekä Euroopassa että Afrikassa.
Keinomunuaishoitoon käytetyn veritien tukoksen hoitoon tähtäävät markkinat jakautuvat kolmeen osaan: valtimo-laskimofistelin kypsyminen, uusintatoimenpiteet ja ylläpito. APAC kohdennetaan ensin valtimo-laskimofistelin kypsymiseen, mutta sen odotetaan soveltuvan näihin kaikkiin markkinasegmentteihin. VasQ-tukiverkko ja sirolimuusia erittävä kollageeni-istute kohdistuvat vain valtimo-laskimofistelin kypsymiseen. APACia voidaan myös käyttää yhdessä näiden tuotteiden kanssa, koska APACin toimintamekanismi on synergistinen. Lisäksi APAC annostellaan suoraan fisteliin, kun muut mainitut tuotteet asetetaan sen ulkopuolelle. APACista voi lisäksi tulla antikoagulantti viikoittaisten dialyysihoitojen toteuttamiseksi.
Perifeerinen valtimosairaus / alaraajan kriittinen hapenpuute
Perifeerisessä valtimosairaudessa (Peripheral Arterial Disease, PAD) verenkierto alaraajoissa heikkenee aterotromboottisten valtimoiden takia. Valtimotaudissa (ateroskleroosi) valtimoseinämiin kertyy tulehdusta ylläpitävää kolesterolia, plakkia, joka saa aikaan verihyytymien muodostumista. Perifeeriseen valtimosairauteen liittyvä sairastuvuus ja kuolleisuus on huomattavaa, koska näillä potilailla ateroskleroosia yleensä esiintyy verisuonistossa laaja-alaisesti. Näin sydänkohtauksen ja aivohalvauksen (yleisimmät valtimotukoksesta johtuvat kuolinsyyt) sekä alaraaja-amputaation riski on merkittävä. Sairastuneessa raajassa oireina ovat katkokävely (klaudikaatio eli kävellessä tuntuva alaraajakipu), huono ääreisverenkierto, parantumattomat haavat, äkillinen ja toistuva tromboosi ja kudoskuolio. Hoitomahdollisuudet ovat rajalliset ja keskittyvät lähinnä elämäntapamuutoksiin, riskitekijöiden hallintaan (kohonnut verenpaine ja kolesteroli), pitkäaikaiseen systeemiseen verihiutale-estäjä-/antikoagulanttihoitoon, sairastuneen raajan revaskularisaatioon ja muiden hoitomuotojen epäonnistuessa raajan amputaatioon.
Sairaissa perifeerisissä valtimoissa veren säätelemätön hyytyminen on keskeinen taudin etenemisen osatekijä. Hyytymisen biomarkkerit, kuten fibrinogeeni ja D-dimeeri, korreloivat sairauden vaikeusasteen ja hoitotulosten kanssa. Usein hyytymishäiriö jatkuu sairastuneen raajan onnistuneen revaskularisaation jälkeenkin.
Alaraajan kriittinen hapenpuute (CLI) on perifeerisen valtimotaudin (PDA) vakavin muoto (4–6 Rutherfordin luokituksessa), jossa kuolleisuus- ja amputaatioluvut ovat suurimmat, kuten alla olevissa kuvissa esitetään:
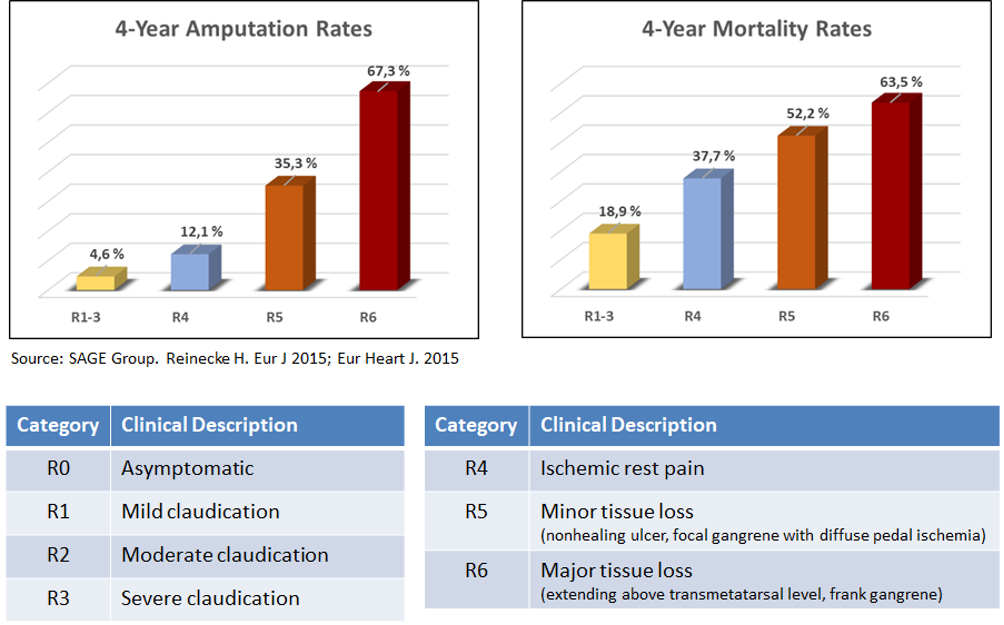
Pelkästään alaraajan kriittisen hapenpuutteen hoidossa arvioidaan olevan 12 miljardin dollarin arvoiset markkinamahdollisuudet, sillä yksin Yhdysvalloissa ja Euroopassa potilaita on jopa 7–8 miljoonaa.
Taudin hoitoon on kehitteillä vain vähän lääkkeellisiä hoitomuotoja, joista yksikään ei vastaa toimintamekanismiltaan APACia. Useimmat kehitteillä olevat hoitomuodot perustuvat geeni- tai soluterapiaan. Niiden tavoitteena on kasvattaa sairastuneessa raajassa uutta verisuonistoa niillä alaraajan kriittistä hapenpuutetta sairastavilla potilailla, joilla revaskularisaatio ei ole mahdollista. Saadut tulokset ovat olleet vaihtelevia.
APACin vaikutus kohdistuu aterotromboottisiin verisuoniin, joissa se vaimentaa hyytymis- ja tulehdusreaktioita. APACia voidaan käyttää sairastuneen raajan revaskularisaatioiden yhteydessä (leikkaus tai pallolaajennus ja sen jälkeinen sairaalahoito) ja laskimoon annosteltavana ylläpitohoitona. Useimmat markkinoilla tai kehitteillä olevat hoitovaihtoehdot ovat todennäköisemmin APACia täydentäviä kuin sitä korvaavia.
Kehittämissuunnitelma
Aplagonin päätavoite on saattaa loppuun faasien 1 ja 2 kliininen tutkimus COVID-19-taudissa sekä faasin 1/2 kliininen tutkimus keinomunuaishoitoon käytetyn veritien tukoksessa (valtimo-laskimofistelin kypsyminen). Aplagon valmistelee myös faasin 2a kliinistä tutkimusta myöhäisvaiheen perifeerisessä valtimotaudissa / alaraajan kriittisessä hapenpuutteessa ja jatkaa sekä kliinistä kehitystä että yhteistyöhankkeita tukevaa tutkimusta ja tuotekehitystä. Tutkimukset tehdään sekä eurooppalaisten (EMA) että yhdysvaltalaisten (FDA) säädösten mukaisesti.
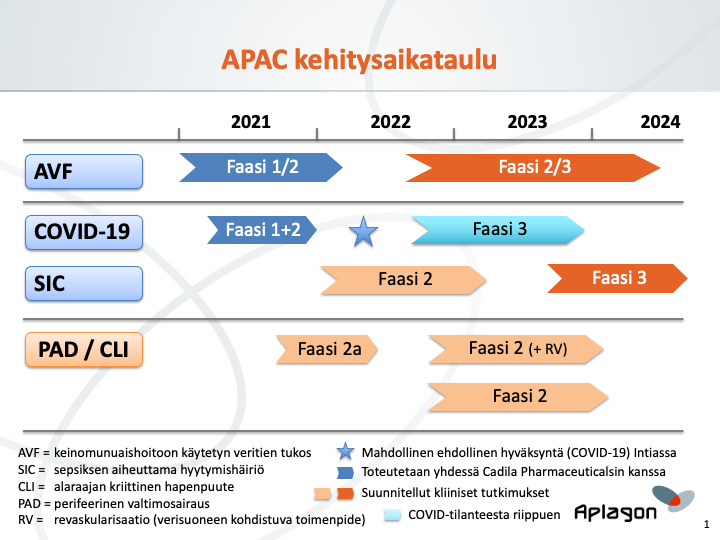
- Faasien 1 ja 2 kliiniset tutkimukset COVID-19-taudissa
- COVID-19-tutkimusta koskeva kliinisen tutkimuksen lupahakemus (CTA) on toimitettu Intian sääntelyviranomaiselle DCGI:lle maaliskuun alussa 2021. Aplagon odottaa, että COVID-19-tautiin keskittyvälle tutkimukselle myönnetään viranomaisten tarkastusprosessissa nopeutettu käsittely. Tutkimuksen odotetaan alkavan vuoden 2021 toisella vuosineljänneksellä ja päättyvän vuoden 2021 loppuun mennessä. Tutkimuksen on suunniteltu jakautuvan kahteen osaan: faasi 1 ja faasi 2.
- Faasissa 1 kymmenen tervettä vapaaehtoista saa APACia neljällä eri annostasolla. Faasissa 1 ensisijaisena tavoitteena on määrittää APACin turvallisuus- ja siedettävyysprofiili terveillä vapaaehtoisilla laskimoon annettavilla, suurenevilla yksittäis- ja moniannoksilla. Faasin 1 aikana selvitetään myös faasissa 2 käytettävä annos.
- Faasissa 2 60 COVID-19-potilasta satunnaistetaan kahteen hoitoryhmään. 30 potilasta saa sekä APACia että vakiohoitoa (ilman pienimolekyylistä hepariinia) ja 30 potilasta vakiohoitoa. Ensisijaisena tavoitteena on osoittaa APACin alustava turvallisuus ja tehokkuus tutkimuspotilailla. Turvallisuutta arvioidaan verenvuotoriskien tai muiden mahdollisten haittavaikutusten suhteen. Tehokkuuden vastemuuttujia ovat muutos sairauden vakavuudessa WHO:n järjestyslukuasteikolla, muutos biomarkkereissa (kuten fibrinogeenissä ja D-dimeerissä), sairaalajakson kesto sekä invasiivisen/mekaanisen ventilaation tarve. Potilaita seurataan enintään 28 vuorokauden ajan.
- Faasin 1/2 kliininen tutkimus keinomunuaishoidon veritien kypsymisestä
- Keinomunuaishoidon veritietä koskevan kliinisen tutkimuksen lupahakemus (CTA) toimitettiin Intian lääkeviranomaiselle DCGI:lle vuoden 2020 toisella vuosineljänneksellä. Lupahakemuksen käsittely viivästyi Intiassa vallinneen COVID-19-sulun takia mutta on nyt meneillään. Tutkimuksen odotetaan alkavan vuoden 2021 toisella vuosineljänneksellä ja kestävän enimmillään noin vuoden ajan. Tutkimukseen odotetaan osallistuvan 30 loppuvaiheen munuaistautia sairastavaa potilasta, jotka jaetaan kolmeen kymmenen potilaan APAC-annosryhmään. Jokaisessa ryhmässä kahdeksan potilasta saa APACia ja kaksi vertailuliuosta. APAC annostellaan paikallisesti ranteen yläpuolelle tehtävään valtimo-laskimofisteliin (AFV) fistelin luomisen yhteydessä. Ensisijainen vastemuuttuja on turvallisuus. Toissijaisina vastemuuttujina ovat valtimo-laskimofistelin kypsymiseen (soveltuvuus dialyysikäyttöön) liittyvät tehokkuusarvioinnit. Potilaita seurataan 4 viikon ajan.
Muu toiminta
- Aplagon suunnittelee jatkavansa seuraavia toimenpiteitä:
- Faasin 2a kliinisen tutkimuksen valmistelut myöhäisvaiheen perifeerisessä valtimosairaudessa (PAD) / alaraajan kriittisessä hapenpuutteessa (CLI) ja hyytymisaktivaatiossa. Tutkimukseen liitetään radiomerkityllä APACilla tehty PET-kuvannus, jolla määritetään APACin jakaantuminen elimistössä ja kiinnittyminen verisuonten vauriokohtiin näillä potilailla. Mukana on myös lyhyt hoitojakso, jonka aikana seurataan potilaiden taudinkulkua ja biomarkkereita.
- Kliinisen kehityksen ja yhteistyöhankkeiden tukeminen tutkimus- ja tuotekehitystyöllä yrityksen laboratoriossa Biomedicumissa Helsingissä ja useiden kansainvälisten kumppanien kanssa.
- APACin annostelumuodon (formulaation) kehitystyön jatkaminen Cadila Pharmaceuticalsin kanssa ja optimointi kaupalliseen käyttöön.
- Neuvottelut APACin potentiaalisten kaupallistamiskumppaneiden kanssa.
Patentit
Aplagon on turvannut APACiin liittyvät immateriaalioikeudet patenteilla ja tietosuojalla.
- Aplagon haki patenttia APACille ja vastaavantyyppisille molekyylikonjugaateille elokuussa 2014. Patenttihakemus siirtyi kansalliseen vaiheeseen helmikuussa 2017 myönteisen kansainvälisen patenttitutkinnan 2016 jälkeen. Patentti on jo myönnetty Australiassa, Etelä-Afrikassa, Euroopassa, Hongkongissa, Japanissa, Kiinassa, Meksikossa, Singaporessa ja Venäjällä. Patentti antaa APACille patenttisuojan elokuuhun 2035 asti ilman voimassaoloajan pidennyksiä. Aplagonin tavoitteena on saavuttaa kattava patenttisuoja kaikilla keskeisillä markkina-alueilla.
- Aplagon jätti toukokuussa 2020 toisen patenttihakemuksen, joka ei vielä ole julkinen.
- Patentit ja patenttihakemukset omistaa Aplagon.
- Lisäksi Aplagon odottaa, että APACille myönnetään myyntiluvan saamisen jälkeen Euroopassa 10 vuoden ja Yhdysvalloissa 12 vuoden tietosuoja.
Tiimimme
Aplagonilla on APACin kehitys- ja kaupallistamistyössä mukana erittäin kokenut kansainvälinen tiimi. Operatiivisen ryhmän jäsenet ovat työskennelleet APACin kehitystyön parissa jo vuosien ajan. Aplagon tekee yhteistyötä kokeneiden ammattilaisten kanssa, mutta haluaa samalla pitää sekä liiketoimintansa että kustannuspohjansa mahdollisimman joustavina. Monet tiimin jäsenistä eivät ole tästä syystä Aplagonin omia työntekijöitä.

Aki PrihtiToimitusjohtaja
Aki nimitettiin Aplagonin toimitusjohtajaksi helmikuussa 2015. Hänellä on yli 20 vuoden kokemus life science -sektorin kasvuyhtiöistä sekä operatiivisessa roolissa että hallituksen jäsenenä. Aki on yksi Inveni Capitalin, life sciences -sektorille keskittyvän pääomasijoitusrahaston, perustajista. Hän on mukana Herantis Pharma Oyj:n, Medtentia International Ltd Oy:n (myös väliaikaisesti osa-aikaisena CFO:na), Onbone Oy:n sekä Aranda Pharma Oy:n hallituksissa. Hän on ollut perustamassa ja kehittämässä useita life science -yrityksiä ja hankkimassa niille rahoitusta.

Riitta LassilaCSO
Riitta on Aplagonin CSO ja yksi sen perustajista. Sen lisäksi hän johtaa HYKSin hyytymishäiriöyksikköä ja toimii hyytymislääketieteen professorina Helsingin yliopistossa. Hän on erikoistunut sisätauteihin, ja hänellä on useiden vuosien kokemus tromboosi- ja hemostaasitutkimuksista. Hän on aikaisemmin johtanut tutkimusryhmää Wihurin tutkimuslaitoksessa Helsingissä. Hän on kirjoittanut yli 300 vertaisarvioitua julkaisua, tutkimuskatsausta tai kirja-artikkelia. Riitta on ollut jäsenenä EAHADin ja EUHANETin ohjauskomiteoissa (eurooppalainen verenvuototautien verkosto). Hän on mukana useiden lääkeyhtiöiden neuvoa-antavissa lautakunnissa. Hänet on valittu Suomalaisen Tiedeakatemian jäseneksi.

Annukka JouppilaTutkija
Annukka on biokemisti ja tutkija, ja hän ollut mukana APACin kehitystyössä Aplagonin perustamisesta lähtien. Annukka johtaa Aplagonin laboratoriota Biomedicumissa Helsingissä ja tukee Aplagonin yhteistyökumppaneita tuotannossa ja prekliinisissä tutkimuksissa.

Nick MeyersKonsultti / Vice President, Tuotekehitys, Boyd Consultants
Nick toimii Boyd Consultants -yhtiön Vice Presidentinä ja työskentelee Aplagonille osa-aikaisena konsulttina. Hän osallistuu APACin tuotekehitykseen tiiviisti ja vetää kaksi kertaa kuukaudessa Cadila Pharmaceuticalsin kanssa pidettäviä projektitiimin kokouksia. Hänellä on yli 20 vuoden kokemus lääkekehityksestä, erityisesti kliinisistä tutkimuksista ja sääntelyasioista, sillä hän on ollut johtotehtävissä muun muassa Alizyme Therapeutics Ltd:llä ja Phytopharm plc:llä.

Bob HumphriesKonsultti / Johtaja, VisionRealisation
Bob toimii VisionRealisation-yhtiössä johtajana ja työskentelee Aplagonille osa-aikaisena konsulttina. Hänen vastuualueenaan ovat kliinisiin tutkimuksiin liittyvät kysymykset. Aikaisemmin hän on muun muassa johtanut antitromboottisten lääkkeiden, tikagrelorin ja kangrelorin, kehitysohjelmia AstraZenecalla. Sekä tikagrelori että kangrelori ovat tällä hetkellä markkinoilla, ja tikagrelorin myynti on yli 1 miljardi dollaria.

Gijs van DedemKonsultti / Neuvonantaja, neuvoa-antavan tieteellisen lautakunnan jäsen
Gijs on tunnettu hepariinikemian asiantuntija, ja hänellä on avainrooli tuotantoon liittyvissä asioissa. Hän työskentelee Aplagonille osa-aikaisena konsulttina. Gijs on ollut mukana luomassa Organonin kehittämää danaparoidia (Orgaran®), heparinoidia antitromboottista lääkettä, jonka Aspen Pharma myöhemmin osti. Hän on uransa aikana toiminut muun muassa pääbiokemistinä Organonilla ja analyyttisen biokemian professorina Delftin teknillisessä yliopistossa Alankomaissa. Sen lisäksi hän on Royal Dutch Chemical Society- ja Royal Dutch Biochemical Society -seurojen jäsen.

Angela Stokes,Konsultti / CEO, Sharp Regulatory Consulting Ltd
Angela on Sharp Regulatory Consulting -yhtiön CEO/Director, ja hän työskentelee Aplagonille osa-aikaisena konsulttina. Hänen vastuullaan ovat erityisesti sääntelyasiat. Angelalla on yli 30 vuoden kokemus sääntelyasioista vastuullisissa tehtävissä johtavissa lääkealan tutkimuspalveluyrityksissä (CRO), kuten Syneos Healthilla (Head of Global Regulatory Consulting), INC Researchilla ja Chilternillä. Hän on ollut töissä myös Eisailla ja Genzymellä. Hän on lisäksi mukana sääntelyalan asiantuntijoille tarkoitetun järjestön TOPRAn hallituksessa.

Simon Craige, Konsultti / Director, Edge Toxicology Consulting Ltd
Simon toimii johtajana EdgeToxicology Consulting -yhtiössä ja työskentelee Aplagonille osa-aikaisena konsulttina. Hänen vastuualueenaan ovat toksikologian alaan liittyvät kysymykset. Hänellä on yli 20 vuoden kokemus toksikologiasta ja prekliinisestä kehityksestä. Aikaisemmin urallaan hän on toiminut Non-Clinical – Regulatory Consulting -yksikön johtajana Syneos Healthilla.

Sakari LassilaHallituksen puheenjohtaja
Sakarilla, yhdellä Aplagonin perustajista, on yli 30 vuoden kokemus kansainvälisistä liike- ja investointipankeista, yritysrahoituksesta ja sijoitusyhtiöiden johtamisesta. Hän on toiminut johtotehtävissä Suomen Yhdyspankissa (nykyään osa Nordeaa), Citibankissa, Alfred Bergillä ja Carnegiella. Hän on tällä hetkellä aktiivinen hallituksen jäsen sekä yksityisomisteisissa että listatuissa yhtiöissä kuten myös eräässä voittoa tavoittelemattomassa säätiössä.

Harry HolthöferHallituksen jäsen
Harrylla on paljon kansainvälistä kokemusta diabeteksen, sydän- ja verisuonitautien sekä munuaissairauksien translaatiotutkimuksista. Hän on toiminut bioanalyyttisten tieteiden professorina sekä johtajana ja puheenjohtajana Dublinin yliopiston Centre for BioAnalytical Sciences -keskuksessa vuosina 2006–2016. Tällä hetkellä hän työskentelee Research Directorina Helsingin yliopistossa, Adjunct Professorina Shenzhenin yliopistossa Kiinassa sekä Visiting Professorina Hampurin yliopistossa Saksassa. Harry on myös ollut mukana perustamassa kolmea biotekniikan alan start-up-yritystä ja toiminut niiden toimitusjohtajana.

Kai LindevallHallituksen jäsen
Kailla, yhdellä Aplagonin perustajista ja Encorium Groupin entisellä toimitusjohtajalla ja CEO:lla, on yli 20 vuoden kokemus life sciences -sektorilta sekä ylemmän johdon tehtävissä että yrittäjänä. Lääkeyhtiöt, biotekniikka-alan yritykset ja lääkealan tutkimuspalveluyritykset ovat hänelle tuttuja. Hän on ollut perustamassa Remediumia (Encoriumin edeltäjää) ja Ipsat Therapiesia ja toiminut Medical Advisorina Farmoksella, Medical Directorina Rhône-Poulenc Rorerilla sekä nimikkeellä Associate Director of Research Wihurin tutkimuslaitoksessa, jossa hän johti omaa tromboositutkimukseen keskittyvää tutkimusryhmäänsä. Kai toimii hallituksen puheenjohtajana hiljattain perustetussa yrityksessä Siltana Ltd:ssä, joka kehittää uusia mobiiliratkaisuja lääketurvallisuuden ja tiedonsaatavuuden tehostamiseen.

Steven MyintHallituksen jäsen / neuvoa-antavan tieteellisen lautakunnan puheenjohtaja
Steven toimii hallituksen puheenjohtajan neuvonantajana singaporelaisessa Agency for Science and Technologyssa sekä muissa virallisissa järjestöissä. Hänen aiempia roolejaan ovat Executive Chairman Green Signal Bio -yhtiössä, joka on yksi Intian suurimmista itsenäisistä rokotevalmistajista, Global Medical Director GlaxoSmithKlinella sekä Vice-President for R&D/Chief Medical Officer BTG Internationalilla. Hän on aktiivisesti mukana innovatiivisissa biotekniikkayrityksissä ja ollut perustamassa Suomen suurinta yrityshautomorahastoa. Steve on jäsenenä tai fellow’na useissa arvostetuissa brittiläisissä tieteellisissä seuroissa, kuten Institute of Knowledge Transferissä, Royal College of Physiciansissa sekä Royal Society of Medicinessä.

Neuvoa-antava tieteellinen lautakunta
Aplagonilla on laaja kansainvälinen tieteellisten ja kliinisten neuvonantajien verkosto. Tieteelliseen lautakuntaan kuuluvat seuraavat henkilöt: Anders Albäck (HYKS), Douglas Cines (Pennsylvanian yliopisto, Yhdysvallat), Adam Cuker (Pennsylvanian yliopisto, Yhdysvallat), Alexander Cohen (Guy’s and St Thomas’ Hospital, King’s College, Yhdistynyt kuningaskunta), Jonathan Himmelfarb (Washingtonin yliopisto, Yhdysvallat) sekä Michael Kroll (MD Anderson Cancer Center, Yhdysvallat).
Rahojen käyttötarkoitus
Arvonmääritys
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.
Tietoa annin ehdoista
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.
Taloustiedot
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.
Riskit
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.
Liitteet
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.
Päivityksiä
Kirjaudu sisään
Sisältö on saatavilla vain sijoittajille jotka ovat sijoittaneet tähän rahoituskierrokseen.